quarta-feira, 19 de fevereiro de 2014
desculpas
Galera, eu fiquei muito tempo (com enfase no muito) sem escrever. eu estou aceitando sugestões de animais/plantas, espero que me ajudem com o blog, esse blog já tem dois anos, eu o criei quando tinha 10 anos (sim, eu sou um pré-adolescente de 12) espero que o blog tenha ajudado vocês em pesquisas escolares, foi para isso e para o lazer que eu o criei, foi apenas uma tentativa de criar algo e escapar do tédio. Me desculpem pelo tempo sem postar. eu não imaginaria que teria varias pessoas de países diferentes usando o blog. Comentem sugestões galera!, muito obrigado pela atenção.
quinta-feira, 24 de janeiro de 2013
Arthropleura
Arthropleura
Maior artrópode terrestre da historia!!! ( bichinho grande, hein?? )
Se voce visse um desses, oque faria?
.
.
.
.
( sorte que esta extinto )
o Arthropleura também é conhecido como "centopeia gigante"  =
= 
sábado, 21 de julho de 2012
Tabela periódica
Tabela periódica
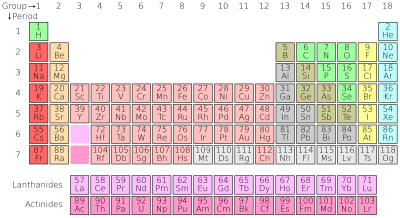 |
| ↑clique para ver maior na wikipedia |
A tabela periódica dos elementos químicos é a disposição sistemática dos elementos, na forma de uma tabela, em função de suas propriedades. São muito úteis para se preverem as características e tendências dos átomos. Permite, por exemplo, prever o comportamento de átomos e das moléculasdeles formadas, ou entender porque certos átomos são extremamente reativos enquanto outros são praticamente inertes. Permite prever propriedades como eletronegatividade, raio iônico, energia de ionização.
História
A tabela periódica consiste num ordenamento dos elementos conhecidos de acordo com as suaspropriedades físicas e químicas, em que os elementos que apresentam as propriedades semelhantes são dispostos em colunas. Este ordenamento foi proposto pelo químico russo Dmitri Mendeleiev , substituindo o ordenamento pela massa atômica. Ele publicou a tabela periódica em seu livro Princípios da Química em 1869, época em que eram conhecidos apenas cerca de 60 elementos químicos.
Em 1789, Antoine Lavoisier publicou uma lista de 33 elementos químicos. Embora Lavoisier tenha agrupado os elementos em gáses, metais, não-metais e terras, os químicos passaram o século seguinte à procura de um esquema de construção mais precisa. Em 1829, Johann Wolfgang Döbereiner observou que muitos dos elementos poderiam ser agrupados em tríades (grupos de três) com base em suas propriedades químicas. Lítio, sódio e potássio, por exemplo, foram agrupados como sendo metais suaves e reativos. Döbereiner observou também que, quando organizados por peso atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e do terceiro.[1] Isso ficou conhecido como a lei das tríades.[carece de fontes] O químico alemão Leopold Gmelin trabalhou com esse sistema e por volta de 1843 ele tinha identificado dez tríades, três grupos de quatro, e um grupo de cinco. Jean Baptiste Dumas publicou um trabalho em 1857 descrevendo as relações entre os diversos grupos de metais. Embora houvesse diversos químicos capazes de identificar relações entre pequenos grupos de elementos, não havia ainda um esquema capaz de abranger todos eles.[1]
O químico alemão August Kekulé havia observado em 1858 que o carbono tem uma tendência de ligar-se a outros elementos em uma proporção de um para quatro. O metano, por exemplo, tem um átomo de carbono e quatro átomos de hidrogênio. Este conceito tornou-se conhecido como valência. Em 1864, o também químico alemão Julius Lothar Meyerpublicou uma tabela com os 49 elementos conhecidos organizados pela valência. A tabela revelava que os elementos com propriedades semelhantes frequentemente partilhavam a mesma valência.[2]
O químico inglês John Newlands publicou uma série de trabalhos em 1864 e 1865 que descreviam sua tentativa de classificar os elementos: quando listados em ordem crescente de peso atômico, semelhantes propriedades físicas e químicas retornavam em intervalos de oito, que ele comparou a oitavas de músicas.[3][4] Esta lei das oitavas, no entanto, foi ridicularizada por seus contemporâneos.[5]
O professor de química russo Dmitri Ivanovich Mendeleiev e Julius Lothar Meyer publicaram de forma independente as suas tabelas periódicas em 1869 e 1870, respectivamente. Ambos construíram suas tabelas de forma semelhante: listando os elementos de uma linha ou coluna em ordem de peso atômico e iniciando uma nova linha ou coluna quando as características dos elementos começavam a se repetir.[6] O sucesso da tabela de Mendeleiev surgiu a partir de duas decisões que ele tomou: a primeira foi a de deixar lacunas na tabela quando parecia que o elemento correspondente ainda não tinha sido descoberto.[7] Mendeleiev não fora o primeiro químico a fazê-lo, mas ele deu um passo adiante ao usar as tendências em sua tabela periódica para predizer as propriedades desses elementos em falta, como ogálio e o germânio.[8] A segunda decisão foi ocasionalmente ignorar a ordem sugerida pelos pesos atômicos e alternar elementos adjacentes, tais como o cobalto e o níquel, para melhor classificá-los em famílias químicas. Com o desenvolvimento das teorias de estrutura atômica, tornou-se aparente que Mendeleev tinha, inadvertidamente, listado os elementos por ordem crescente de número atômico.[9]
Com o desenvolvimento da modernas teorias mecânica quânticas de configuração de eletrons dentro de átomos, ficou evidente que cada linha (ou período) na tabela correspondia ao preenchimento de um nível quântico de elétrons. Na tabela original de Mendeleiev, cada período tinha o mesmo comprimento. No entanto, porque os átomos maiores têm sub-níveis, tabelas modernas têm períodos cada vez mais longos na parte de baixo da tabela.[10]
Em 1913, através do trabalho do físico inglês Henry G. J. Moseley, que mediu as frequências de linhas espectrais específicas de raios X de um número de 40 elementos contra a carga do núcleo (Z), pôde-se identificar algumas inversões na ordem correta da tabela periódica, sendo, portanto, o primeiro dos trabalhos experimentais a ratificar o modelo atômico de Bohr. O trabalho de Moseley serviu para dirimir um erro em que a Química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atômica e não pelo número atômico.
Nos anos que se seguiram após a publicação da tabela periódica de Mendeleiev, as lacunas que ele deixou foram preenchidas quando os químicos descobriram mais elementos químicos. O último elemento de ocorrência natural a ser descoberto foi o frâncio (referido por Mendeleiev como eka-césio) em 1939.[11] A tabela periódica também cresceu com a adição de elementos sintéticos e transurânicos. O primeiro elemento transurânico a ser descoberto foi o netúnio, que foi formado pelo bombardeamento de urânio com nêutronsnum ciclotron em 1939.[12]
Estrutura da tabela periódica
| Grupo # | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Período | ||||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | ||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | (117) (Uus) | 118 Uuo | ||
| * Lantanídios | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||
| ** Actinídios | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||||
| Metais alcalinos2 | Metais alcalinoterrosos2 | Metais de transição2 | Lantanídios1, 2 | Actinídios1, 2 | Metais representativos | Semimetais | Não metais | Halogênios3 | Gases nobres3 |
- 1Actinídios e lantanídios são conhecidos coletivamente como “metais terrosos raros”.
- 2Metais alcalinos, metais alcalinoterrosos, metais de transição, actinídios e lantanídios são conhecidos coletivamente como “metais”.
- 3Halogênios e gases nobres também são não metais.
-
- Estado físico do elemento nas Condições Normais de Temperatura e Pressão (CNTP)
- aqueles com o número atômico em preto são sólidos nas CNTP.
- aqueles com o número atômico em verde são líquidos nas CNTP;
- aqueles com o número atômico em vermelho são gases nas CNTP;
- aqueles com o número atômico em cinza têm estado físico desconhecido.
- Ocorrência natural
- Borda sólida indica existência de isótopo mais antigo que a Terra (elemento primordial).
- Borda tracejada indica que o elemento surge do decaimento de outros.
- Borda pontilhada indica que o elemento é produzido artificialmente (elemento sintético).
- A cor mais clara indica elemento ainda não descoberto.
A tabela periódica relaciona os elementos em linhas denominadas períodos e colunas chamadas grupos ou famílias, em ordem crescente de seus números atômicos (Z).Períodos
Os elementos de um mesmo período têm o mesmo número de camadas eletrônicas, que corresponde ao número do período. Os elementos conhecidos até o cobre tem sete períodos, denominados conforme a sequência de letras K-Q, ou também de acordo com o número quântico principal- n.Os períodos são:- (1ª) camada K - n = 2s
- (2ª) Camada L - n = 8s
- (3ª) Camada M - n = 18s
- (4ª) Camada N - n = 32s
- (5ª) Camada O - n = 32s
- (6ª) Camada P - n = 18s
- (7ª) Camada Q - n = 2 à 8s
Grupos
Antigamente, chamavam-se "famílias". Os elementos do mesmo grupo têm o mesmo número de elétrons na camada de valência (camada mais externa). Assim, os elementos do mesmo grupo possuem comportamento químico semelhante. Existem 18 grupos sendo que o elemento químico hidrogênio é o único que não se enquadra em nenhuma família e está localizado em sua posição apenas por ter número atômico igual a 1, isto é, como tem apenas um elétron na última camada, foi colocado no Grupo 1, mesmo sem ser um metal.Na tabela os grupos são as linhas verticais (de cima para baixo)Classificações dos elementosDentro da tabela periódica, os elementos químicos também podem ser classificados em conjuntos, chamados de séries químicas, de acordo com sua configuração eletrônica:- Elementos representativos: pertencentes aos grupos 1, 2 e dos grupos de 13 a 17.
- Elementos (ou metais) de transição: pertencentes aos grupos de 3 a 12.
- Elementos (ou metais) de transição interna: pertencentes às séries dos lantanídios e dos actinídios.
- Gases nobres: pertencentes ao grupo 18.
Além disso, podem ser classificados de acordo com suas propriedades físicas nos grupos a seguir:- Metais;
- Semimetais ou metalóides (termo não mais usado pela IUPAC: os elementos desse grupo distribuíram-se entre os metais e os ametais);
- Ametais (ou não-metais);
- Gases nobres;
- Hidrogênio.
PERGUNTA AOS EXPERTS:COMO LEMBRARDESTATABELA INTEIRA?
Assinar:
Postagens (Atom)
top 10 postagens
-
Ariranha Ariranha Estado de conservação Em perigo Classificação científica Reino : Animalia Filo : Chordata Classe :...
-
Barata Blattaria Periplaneta americana Estado de conservação Pouco preocupante Classificação científica Reino : Animalia...
-
Galera, eu fiquei muito tempo (com enfase no muito) sem escrever. eu estou aceitando sugestões de animais/plantas, espero que me ajudem com ...

